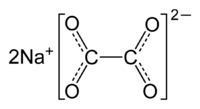
Oxalato de sodio
 |
La forma mineral del oxalato sódico es el natroxalato. Se encuentra en esta forma mineral sólo muy raras veces, y se limita a condiciones extremadamente sódicas de pegmatitas ultra-alcalinas.
CARACTERÍSTICAS
El oxalato de sodio es un polvo blanco, cristalino, y sin olor, que se descompone a 250-270°C. Es ligeramente higroscópico y, por lo tanto, debe usarse con cuidado durante la desecación en el trabajo de laboratorio (química analítica) en la que la absorción de agua es importante. Al oxalato disódico se le llama con frecuencia oxalato de sodio. Ya que el ion poliatómico del oxalato tiene dos cargas negativas, no puede haber otro compuesto que consista de sodio y oxalato que no sea el oxalato disódico. En consecuencia, el prefijo "di" se elimina.
Su solubilidad en agua es de 3,7 g/100 ml a 20°C y 63 g/100 ml a 100°C. Su pH es de 8 a una temperatura de 20°C en solución acuosa a concentración de 30 g/litro. Tiene una densidad de 2,34 g/cm3 y una densidad aparente de alrededor de 600 kg/m3.
OBTENCIÓN
El oxalato de sodio se puede obtener por reacción del ácido oxálico con el hidróxido de sodio:
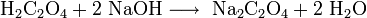
Industrialmente, se produce por calentamiento a 360°C del formiato de sodio (metanoato de sodio):
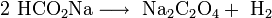
Además, se produce en grandes cantidades como residuo del proceso de Bayer (producción de hidróxido de aluminio o "alúmina hidratada").
PREPARACIÓN
El oxalato de sodio se puede preparar a través de la neutralización del ácido oxálico con NaOH en una relación molar de 1:2 de ácido-base. La neutralización media se puede lograr con NaOH en una proporción de 1:1, que produce NAHC2O4, oxalato de sodio monobásico o hidrogenoxalato de sodio.
USOS Y APLICACIONES
Basadas en su actividad química
El oxalato de sodio puede actuar como un agente reductor, y puede ser utilizado como patrón primario para la normalización de las soluciones de permanganato potásico (KMnO4). Es deseable que la temperatura de la mezcla de la valoración sea superior a 60°C para garantizar que todo el permanganato añadido reaccione rápidamente. La cinética de la reacción es compleja, y los iones manganato (II) formados catalizan la nueva reacción entre el permanganato y el ácido oxálico (formado in situ por la adición de ácido sulfúrico en exceso). La ecuación final es la siguiente:
5H2C2O4 + 2KMnO4 + 3H2SO4 → K2SO4 + 2MnSO4 + 10CO2 + 8H2O
Basada en su actividad biológica
En experimentos biológicos, tanto el oxalato de sodio como los citratos pueden utilizarse para eliminar iones de calcio (Ca2+) a partir de plasma sanguíneo. También previene la coagulación de la sangre, pero no tiene ningún uso por su toxicidad. Al igual que otros oxalatos, el oxalato de sodio es tóxico para los seres humanos. Puede causar ardor en la boca, la garganta y el estómago, vómitos con sangre, dolor de cabeza, calambres musculares, espasmos y convulsiones, disminución de la presión arterial, insuficiencia cardiaca, shock, coma y muerte. La dosis letal media por ingestión de oxalatos es de 10-15 gramos.
Al eliminar el calcio de la sangre, el oxalato de sodio puede dañar las funciones cerebrales y provocar depósitos de oxalato de calcio (cálculos) en los riñones.